注意事项:
1、申请伦理审查的资料要求:
登陆院内OA,进入伦理审查专栏→伦理审查项目,仔细阅读伦理审查申请流程说明及送审文件清单,按说明准备资料,发送到院内网苏晶晶邮箱。邮件发送成功后需与办公室确认邮件是否送达,伦理委员会受理电子版材料后,由办公室邮件/电话通知研究者递交纸质版材料。
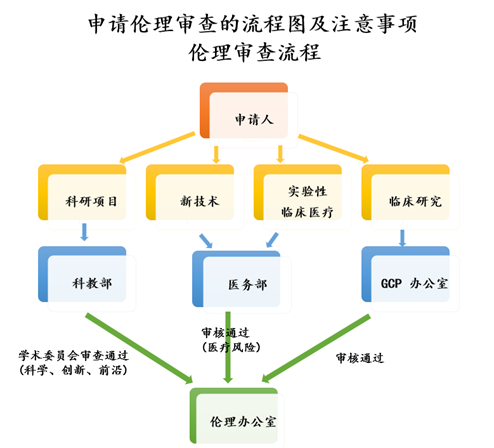
(1)51吃瓜 项目:主要研究者在伦理审查申请流程前,需经过51吃瓜 教学部对研究者申报资格的审核并获其批准。研究者不能自行做出“免除伦理审查”的判断,需由本伦理委员会审查确认。
(2)新技术、新项目临床应用和实验性临床医疗:主要研究者在伦理审查申请流程前,需经过医务部对研究者申报资格的审核并获其批准。
(3)临床研究项目:包括药物临床试验、医疗器械/体外诊断试剂临床试验,主要研究者在进入伦理审查申请流程前,需先经临床试验机构办公室审核并获其批准。
2、递交材料时间:至少在会议前一周将全部资料(包括纸质版和电子版资料)送至伦理委员会办公室。
3、会议审查时间:目前我院召开伦理会议的时间不固定,具体时间根据项目情况而定。
4、伦理审查缴费说明:根据我院财务部门相关规定收取伦理审查费用,以公对公转账形式,并注明“伦理受理编号+伦理审查费”。
账号如下:
账户:51吃瓜
开户行:工行厦门海沧支行
账号:4100026009200188888
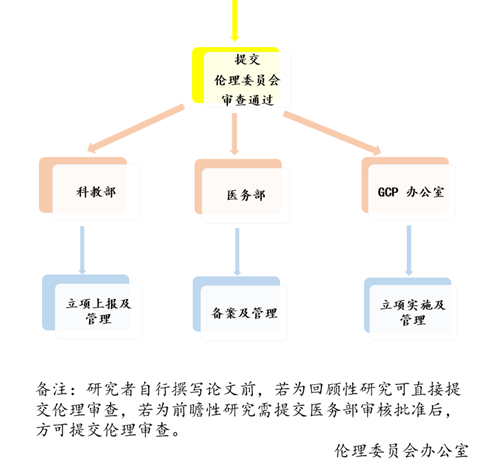
5、领取伦理审查决定时间:审查意见或批件在伦理审查会议后5个工作日内,快审于伦理纸质材料受理后8个工作日内,到3号楼4楼437伦理委员会办公室领取。
6、试验项目自通过伦理审查之日起,开展每满一年或半年(每个项目可能不同,具体见批件要求),申办者或研究者应向伦理委员会提交研究进展报告。
7、安全信息报告:药物临床研究过程中发生的本中心SUSAR,属于致死或危及生命的,申办者应在首次获知后尽快报告,但不得超过7天,并在随后的8天内报告、完善随访信息(申办者首次获知当天为第0天);属于非致死或危及生命的,申办者应在首次获知后尽快报告,但不得超过15天。医疗器械临床研究过程中发生的本中心SAE:应在研究者获知后24小时内报告。
8、伦理委员会秘书:苏晶晶
外线电话:0592-6589600;内线电话:600;
办公时间:周一~周五(8:00-12:00,14:30-17:30)
地址:厦门市海沧区海裕路89号3号楼4楼437伦理委员会办公室



